L’ApARTé scientifique – Les argiles les plus chaudes de ta région ou étude des transform
- journaledl
- 5 oct. 2019
- 4 min de lecture

Juin 2019. La canicule s’étend comme une chape de plomb brûlante sur la France. La moindre goutte d’eau vous paraît plus désirable que n’importe quel Marcellus ou torse de Milet. Vous portez à votre bouche une bouteille pour hydrater votre muqueuse qui vous semble plus sèche encore que le désert d’Atacama, à l’argile craquelée. Mais une question arrête votre geste : mais comment se fait-il que l’argile devienne imperméable après cuisson quand moi je peux me réhydrater à loisir ? -oui, vous êtes tarés, du moins moi je le suis et je me rassure en vous imaginant comme tel. Mais plus encore, quels sont donc les mécanismes de transformation des matériaux soumis à de fortes températures ? Nous nous contenterons des matériaux inorganiques parce que quand ça brûle … ça brûle quoi -mais ça serait parfait pour un petit bonus de l’été. Alors prend une bière Billy -1 litre et demi selon FR3, #seventies- et embarquons pour les magnifiques rivages de la physico-chimie !
Pour faire court, les différents éléments se trouvent sous trois états : solide, liquide et gazeux. La différence entre ces états provient de l’agitation moléculaire. L’agitation moléculaire ? Qu’est-ce à dirre que ceci ?! En fait, les molécules au sein de la matière s’agitent, frissonnent, remuent le derrière sur on ne sait quelle musique atomique -en tout cas ça doit être de la bombe ! … tuez moi. Si elle s’agitent peu, la fête moléculaire est au plus bas. Des liaisons moléculaires, telles de petits groupes de discussion, se forment et la matière se trouve donc à l’état solide. Quand l’ambiance se chauffe un peu, l’agitation moléculaire augmente, elles oublient le blabla, les liaisons sont moins fortes et la matière devient liquide (c’et la fusion). Mais si on augmente encore la température, toutes se mettent à twerker, à swinguer, à zouker à tout va et aux quatre vents, plus aucune liaison ne vient les restreindre. La matière arrive alors dans son état gazeux, c’est la vaporisation.

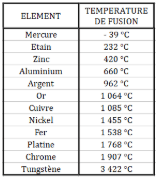
Bon, ça c’est la base, mais cela va nous permettre de répondre à la problématique précédemment édictée -oui je te vois, toi au fond qui ne suis pas et c’est INADMISSIBLE, ne pas se préoccuper ainsi de ces ENJEUX MAJEURS ! … pardon- pour pas mal de matériaux mine de rien. C’est ainsi que l’on parvient à modeler la plupart des métaux, voici un petit tableau récapitulatif des points de fusion de quelques uns d’entre eux :
Pour ce qui est du verre, il atteint son point de fusion entre 1400 et 1600 °C selon sa composition (pour information : le verre silicium, qui est le composant principal de la plupart des verres, atteint sont point de fusion à 1 730 °C). Mais il s’agit d’un solide non-cristallin, donc c’est un peu plus compliqué … disons simplement que c’est un peu comme un liquide mais en très très très visqueux. Je vous laisse avec ça, les plus tarés d’entre vous iront se renseigner (notamment sur le transition vitreuse, fascinant …).
Mais passons maintenant plus gros du sujet. Et à la réponse à notre question de départ : pourquoi donc l’argile devient-elle imperméable après cuisson ? Réponse simple de la plupart des sites ou livres : “car elle se transforme en matériau céramique de manière irréversible à très haute température”. Mais votre fidèle fou à lier serviteur ne peut pas se contenter d’une telle réponse, il me fallait aller plus loin. Pour cela, quittons la physique pour la chimie, mon sujet de prédilection : âmes sensibles s’abstenir, il va y avoir de la formule chimique ! Etant donné qu’il existe d’innombrables sortes d’argiles, nous nous contenterons de nous préoccuper de la kaolinite, composante de la plupart d’entre elles.
Premièrement, sachez que la kaolinite (Al2Si2O5(OH)4) est ce que l’on appelle un silicate d’aluminium, soit un composé chimique d’oxyde d’aluminium, ou alumine (Al2O3), et de dioxyde de silicium, ou silice (SiO2). Hors, lors d’une calcination (cuisson), la kaolinite est soumise à plusieurs réactions chimiques se réalisant à certaines températures précises. Ces réactions permettent la formation d’un matériau céramique, moins perméable, en lieu et place de l’argile : c’est la terre cuite.
La première réaction a lieu, à pression atmosphérique, aux environs de 550 °C, c’est la déshydroxylation. En soit, il s’agit de la séparation de groupes hydroxyles (OH) d’un composé chimique par l’adjonction d’hydrogène (H), ce qui donne un composé instable et de l’eau (H2O). Le composé ici formé est un type de métakaolin –Métakaolin. Pokémon de type silicate d’aluminium anhydre (sans eau liée à lui). Existe sous plusieurs formes– (Al2Si2O5). En formule chimique simplifiée (car je ne représente que ce qui m’intéresse ici) ça donne ça :
Al2Si2O5(OH)4 → Al2Si2O5
Ensuite commence le plus gros de la composition chimique. C’est ainsi qu’à 980 °C le métakaolin, réagissant avec du dioxygène (O2) présent dans l’air, se scinde en alumine (Al2O3), en un type de spinelle –Spinelle. Pokémon de type PUTAIN DE COMPLEXE. Ne vaut pas la peine d’aller plus loin– (Al2O3 , 3 SiO2) et en silice amorphe (SiO2). Je vous remet une formule chimique, une bien complète celle-ci :
3 Al2Si2O5 + 6 O2 → Al2O3 + 2 Al2O3 , 3 SiO2 + 3 SiO2
Enfin, à 1 150 °C, l’alumine et le spinelle réagisse ensemble pour former de la mullite, un autre silicate d’aluminium, (Al2O3 , 2 SiO2) et de nouveau de la silice amorphe selon la formule suivante :
Al2O3 + 2 Al2O3 , 3 SiO2 → 3 Al2O3 , 2 SiO2 + SiO2
Et c’est tout. On s’arrête là. Car en effet les cristaux de mullite ainsi formés rendent la structure bien plus imperméable. La mullite étant stable à toutes les température à pression atmosphérique, cette réaction est irréversible et l’argile utilisée ne sera plus jamais la même.
Ah ! Ça fait du bien de répondre de manière satisfaisante à une question qui, si elle ne paraît pas très complexe, représente un vrai casse-tête si on s’y penche un peu. Mais je ne pense pas avoir encore fait le tour de la question. C’est pourquoi je vais sans doute vous proposer un certain nombre de petits bonus estivaux, pour le plus grand plaisir de mon esprit malade et des quelques irréductibles lecteurs qui, en pleines vacances, continuent à lire notre grand et magnifique Louvr’Boîte.
Raphaël Vaubourdolle








Commentaires